Maladie de Parkinson
Anglais : Parkinson’s disease
Description
La maladie de Parkinson est une atteinte neurodégénérative sous-corticale d’origine inconnue qui se présente généralement en une progression lente et un déclin continu des fonctions motrices. Dans sa forme principale, elle se caractérise par des tremblements au repos, une raideur ou rigidité musculaire, une lenteur des mouvements et une instabilité de la démarche et de la posture (Chopade et al., 2023; Frank et al., 2023a; Gonzalez-Usigli, 2022; Organisation mondiale de la santé [OMS], 2023; Parkinson Canada, n.d.; Société Alzheimer du Canada, 2021). La maladie de Parkinson se développe plus souvent chez des personnes âgées.

La forme principale de la maladie de Parkinson représente environ 80 % des cas (Shrimanker et al., 2022), mais il en existe quelques variantes :
- Parkinsonisme juvénile (0 à 20 ans) ou précoce (21 à 40 ans) : plus souvent d’ordre génétique, progression plus lente, plus grande sensibilité aux traitements à la dopamine. Les premiers symptômes sont généralement la dépression, l’anxiété et la douleur, plutôt que des troubles moteurs.
- Parkinsonisme atypique, syndromes parkinsoniens ou troubles Parkinson plus : regroupent des troubles neurodégénératifs ayant certaines caractéristiques de la maladie de Parkinson, mais dont les symptômes cliniques et l’origine pathologique sont différents de ceux de la forme typique de la maladie.
- Parkinsonisme secondaire : regroupe des troubles semblables à ceux de la maladie de Parkinson, mais dont les causes diffèrent (p. ex. coups répétés à la tête chez le boxeur). Il est aussi caractérisé par un dysfonctionnement cérébral attribuable au blocage ou à l’interférence avec l’action dopaminergique dans les noyaux gris centraux.
(Alberta Health, Université de Cambridge, cités dans Société Alzheimer du Canada, 2021; American Association of Neurological Surgeons [AANS], n.d.; Gonzalez-Usigli, 2022; Parkinson Montréal-Laval, n.d.; Shrimanker et al., 2022).
On trouve une description intéressante de la maladie de Parkinson au https://www.youtube.com/watch?v=YU7G__mMqiM (2 min 6 s). On peut aussi consulter des témoignages aux adresses suivantes :
- https://www.youtube.com/watch?v=h6IJ7Bm8X40 (2 min 45 s).
- https://www.youtube.com/watch?v=NpvjlGHcQnU (3 min 52 s)
Données populationnelles
La maladie de Parkinson est la deuxième maladie neurodégénérative la plus fréquente dans la population mondiale (Chopade et al., 2023; Olsson et al., 2020). Environ 2 % de la population âgée de 85 ans et plus en est atteinte, les hommes étant plus touchés que les femmes (Agence de la santé publique du Canada [ASPC], 2019; OMS, 2023).
En 2019, au Canada, on comptait 84 000 personnes de 40 ans et plus atteintes du Parkinson et 10 000 Canadiens étaient diagnostiqués chaque année (ASPC, 2019). Selon les prévisions, le nombre de personnes atteintes doublera d’ici 2031, tandis que le nombre de nouveaux diagnostics augmentera de 50 % (ASPC, 2019).
Étiologie
La cause exacte de la maladie de Parkinson demeure à ce jour inconnue, mais les écrits sur le sujet mentionnent fréquemment trois origines possibles : génétique, environnementale et liée à un traumatisme.
Facteurs de risques et de protection
Les études sur la maladie de Parkinson permettent de constater certains facteurs de risque de développer la maladie :
- L’âge avancé
- Le sexe masculin
- Les troubles du sommeil (insomnie, trouble du comportement en sommeil paradoxal, somnambulisme)
- L’exposition à des facteurs environnementaux :
- Milieux ruraux :
- Eau de puits possiblement contaminée, mais considérée potable
- Herbicides
- Pesticides
- Carbone
- Fer
- Manganèse
- Milieux urbains :
- Pollution de l’air
- Solvants
- Les antécédents familiaux et la génétique (10 % des cas)
- La consommation élevée de produits laitiers
- Un traumatisme (p. ex. traumatisme crânien, AVC)
(Antony et al., Hayes, cités dans Heitz, 2023; AANS, n.d.; Bellou et al., Nandipati et Litvan, cités dans Reichmann et al., 2022; Hughes et al., cités dans Olsson et al., 2020; OMS, 2023; Ordre professionnel de la physiothérapie du Québec [OPPQ], n.d.; Park et al., cités dans Simon et al., 2020; National Institute on Aging [NIA], 2022; Reichmann et al., 2022; Roy et al., 2023; Société Alzheimer du Canada, 2021; Zhang et al., 2021)
Selon certaines études, d’autres facteurs agissent au contraire comme une protection contre la maladie. C’est notamment le cas de la diète méditerranéenne (composée de fruits, de légumes et de grains) et de l’exercice physique régulier (intensité modérée à élevée) (Chen et al., Csoti, Thacker et al., Xu et al., cités dans Reichmann et al., 2022; Gao et al., Yang et al., cités dans dans Simon et al., 2020; Metcalfe-Roach et al., cités dans Roy et al., 2023).
Pathogenèse
Une dégénérescence des neurones pigmentés de la substance noire, du locus ceruleus et d’autres groupes de cellules dopaminergiques du tronc cérébral survient lors de la maladie de Parkinson (AANS, n.d.; Goldin et al., 2023; Gonzalez-Usigli, 2022; Martin et al., Reddy et al., cités dans Chopade et al., 2023; Shrimanker et al., 2022; Simon et al., 2020; Ye et al., 2023). La perte de neurones dopaminergiques au niveau de la substance noire entraîne une diminution de la concentration de dopamine dans la région dorsale du putamen (partie des noyaux gris centraux) et un déséquilibre des neurotransmetteurs dans le striatum (Gonzalez-Usigli, 2022; Shrimanker et al., 2022; Ye et al., 2023). La transmission de l’influx nerveux dans cette région du cerveau, plus particulièrement entre la substance noire et le striatum, se voit ainsi ralentie. La présence accrue d’acétylcholine (neurotransmetteur excitateur) entraîne une surstimulation nerveuse des muscles accentuant le tonus et l’activité musculaires, contribuant ainsi à l’apparition des symptômes.

Par ailleurs, la béta-synucléine (protéine neuronale) et des cellules gliales peuvent former des agrégats de fibrilles et des inclusions appelées corps de Lewy (NIA, 2022; Simon et al., 2020). Le développement typique de la maladie de Parkinson est caractérisé par la présence de corps de Lewy dans la région nigrostriée du cerveau (Aarsland et al., cités dans Heitz, 2023; Gonzalez-Usigli, 2022; Simon et al., 2020; Ye et al., 2023). Quand ces corps de Lewy se retrouvent diffus ailleurs dans le cerveau, il y aura développement d’une démence à corps de Lewy chez la personne atteinte. Cette démence devra être différenciée de celle parfois observée dans l’évolution de la maladie de Parkinson.
La pathogenèse de la maladie de Parkinson est bien présentée au :
Signes et symptômes
Les premiers symptômes du Parkinson apparaissent subtilement, puis la maladie s’aggrave de façon graduelle (NIA, 2022; OMS, 2023; Société Alzheimer du Canada, 2021), jusqu’à affecter de manière importante les activités quotidiennes et la qualité de vie des patients (Gonzalez-Usigli, 2022; OMS, 2023). En effet, les symptômes non moteurs sont parfois présents des années avant les symptômes moteurs (Berg et al., Fereshtehnejad et al., cités dans Ye et al., 2023; Simon et al., 2020).
On peut observer une progression de ces symptômes en trois phases :
| Phase | Description |
| Phase préclinique | Dégénérescence neuronale asymptomatique |
| Phase prodromique | Cette phase, qui peut demeurer de quelques mois à quelques années, est caractérisée par l’apparition de symptômes généralisés moins spécifiques tels que la dépression, l’anxiété, la fibromyalgie ou une douleur aux épaules. |
| Phase symptomatique | Caractérisée par la présence nette de symptômes, cette phase peut être divisée en cinq étapes :
|
Les symptômes de la maladie de Parkinson sont nombreux. Cependant, il faut noter que les symptômes exacts et leur progression varient d’une personne atteinte à une autre (NIA, 2022; Parkinson Québec, cité dans Poitras, 2023; Schapira et al., cités dans Ye et al., 2023; Société Alzheimer du Canada, 2021; Ye et al., 2023). Les patients peuvent donc souffrir de plusieurs combinaisons des symptômes suivants :
Symptômes moteurs
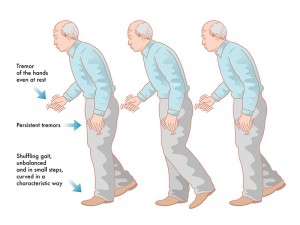
- Tremblements au repos des mains, des pieds, de la mâchoire et de la langue
- Augmentent lors de stress, diminuent lors du mouvement, s’arrêtent durant le sommeil
- Diminuent généralement lorsque la maladie progresse et que la rigidité s’installe
- Rigidité au niveau des épaules, des bras et des jambes
- Peut également toucher le cou, le tronc, les hanches et les chevilles dans certains cas
- Bradykinésie (ralentissement des mouvements)
- Hypokinésie (diminution de l’amplitude des mouvements)
- Akinésie (difficulté à amorcer les mouvements)
- Dyskinésie (mouvements involontaires)
- Symptôme plus tardif
- Instabilité posturale
- P. ex. traîner les pieds, faire de petits pas, avoir une posture penchée, tomber fréquemment
- Symptôme plus tardif
- Réduction des expressions faciales
- P. ex. visage figé, inexpressif et diminution du clignement oculaire
(AANS, n.d.; Antony et al., Hayes, Jankovic, Samii et al., cités dans Heitz, 2023; Berus et al., cités dans Yousif et al., 2023; Chopade et al., 2023; Frank et al., 2023a; Frank et al., 2023b; Gonzalez-Usigli, 2022; Hunker et Abbs, cités dans Shrimanker et al., 2022; NIA, 2022; OMS, 2023; OPPQ, n.d.; Parkinson Montréal-Laval, n.d.; Schrag et al., 2023; Shrimanker et al., 2022; Société Alzheimer du Canada, 2021; Verhoeff et al., 2023)
Symptômes comportementaux et psychologiques
- Dépression
- Anxiété
- Troubles de la santé mentale
- Troubles émotionnels
- Irritabilité
- Apathie
(AANS, n.d.; Almeida et al., cités dans Yousif et al., 2023; Chopade et al., 2023; Frank et al., 2023a; Frank et al., 2023b; Gonzalez-Usigli, 2022; Jankovic, Samii et al., cités dans Heitz, 2023; Khoo et al., cités dans Verhoeff et al., 2023; NIA, 2022; OMS, 2023; OPPQ, n.d.; Parkinson Montréal-Laval, n.d.; Schrag et al., cités dans Schrag et al., 2023; Schrag et al., 2023; Société Alzheimer du Canada, 2021)
Symptômes cognitifs
- Troubles de la mémoire
- Difficulté à être attentif
- Difficulté à planifier et à exécuter des tâches
- Hallucinations
- Psychoses
- Démence
- Touche environ le tiers des patients atteints de Parkinson
- Symptôme plus tardif
(AANS, n.d.; Almeida et al., cités dans Yousif et al., 2023; Chopade et al., 2023; Frank et al., 2023b; Gonzalez-Usigli, 2022; NIA, 2022; OMS, 2023; OPPQ, n.d.; Parkinson Montréal-Laval, n.d.; Schrag et al., 2023; Société Alzheimer du Canada, 2021; Walker et al., Weintraub et al., cités dans Ye et al., 2023)
Symptômes liés au sommeil
Undo New page indentation compress encoding option ico option2 option3 option4 option5 option6 option7 option8 Clean
- Fatigue
- Insomnie
- Peut être due au besoin fréquent d’uriner ou à la difficulté de se retourner
- Somnolence excessive durant la journée
- Trouble du comportement en sommeil paradoxal (mouvements incontrôlés durant le sommeil)
- Apnée du sommeil
(Almeida et al., cités dans Yousif et al., 2023; Berg et al., Fereshtehnejad et al., cités dans Ye et al., 2023; Chopade et al., 2023; Crosta et al., Fereshtehnejad et al., Iranzo et al., Sun et al., cités dans Schrag et al., 2023; Frank et al., 2023a; Frank et al., 2023b; Gonzalez-Usigli, 2022; Jankovic, Samii et al., cités dans Heitz, 2023; OMS, 2023; OPPQ, n.d.; Parkinson Montréal-Laval, n.d.; Schrag et al., 2023; Shrimanker et al., 2022; Société Alzheimer du Canada, 2021)
Symptômes digestifs et urinaires
- Changements d’appétit
- Salivation excessive
- Dysphagie (trouble de déglutition)
- Constipation
- Vessie hyperactive
- Nycturie (besoin fréquent d’uriner)
- Rétention urinaire
- Urgenturie (besoin urgent d’uriner)
- Incontinence
(AANS, n.d.; Frank et al., 2023a; Frank et al., 2023b; Gonzalez-Usigli, 2022; Jankovic, Samii et al., cités dans Heitz, 2023; Kalf et al., cités dans Frank et al., 2023a; NIA, 2022; Parkinson Montréal-Laval, n.d.; Schrag et al., 2023; Société Alzheimer du Canada, 2021; Ye et al., 2023)
Symptômes sensoriels
- Hyposmie (perte partielle de l’odorat)
- Touche environ 70 % à 90 % des patients atteints de Parkinson
- Anosmie (perte complète de l’odorat)
- Touche environ le tiers des patients atteints de Parkinson
- Perte de l’audition
- Troubles sensoriels
(Chopade et al., 2023; Frank et al., 2023a; Gonzalez-Usigli, 2022; Hawkes, Jennings et al., Marrero-González et al., Ponsen et al., Siderowf et al., cités dans Schrag et al., 2023; Khoo et al., cités dans Verhoeff et al., 2023; OMS, 2023; Parkinson Montréal-Laval, n.d.) Autres symptômes physiques • Douleurs musculaires • Dystonie (contractions musculaires involontaires) • Troubles de la parole o P. ex. dysarthrie (difficulté à articuler), bégaiement, voix monotone, volume peu élevé o Touche jusqu’à 90 % des patients atteints de Parkinson • Problèmes de peau o P. ex. irritation, sudation excessive, peau trop huileuse ou trop sèche • Hypotension et étourdissements associés • Troubles sexuels o Touche environ la moitié des patients atteints de Parkinson (Berus et al., cités dans Yousif et al., 2023; Frank et al., 2023a; Frank et al., 2023b; Gonzalez-Usigli, 2022; NIA, 2022; OMS, 2023; OPPQ, n.d.; Parkinson Montréal-Laval, n.d.; Schrag et al., cités dans Schrag et al., 2023; Schrag et al., 2023; Shrimanker et al., 2022; Société Alzheimer du Canada, 2021; Ye et al., 2023)
Autres symptômes physiques
- Douleurs musculaires
- Dystonie (contractions musculaires involontaires)
- Troubles de la parole
- P. ex. dysarthrie (difficulté à articuler), bégaiement, voix monotone, volume peu élevé
- Touche jusqu’à 90 % des patients atteints de Parkinson
- Problèmes de peau
- P. ex. irritation, sudation excessive, peau trop huileuse ou trop sèche
- Hypotension et étourdissements associés
- Troubles sexuels
- Touche environ la moitié des patients atteints de Parkinson
(Berus et al., cités dans Yousif et al., 2023; Frank et al., 2023a; Frank et al., 2023b; Gonzalez-Usigli, 2022; NIA, 2022; OMS, 2023; OPPQ, n.d.; Parkinson Montréal-Laval, n.d.; Schrag et al., cités dans Schrag et al., 2023; Schrag et al., 2023; Shrimanker et al., 2022; Société Alzheimer du Canada, 2021; Ye et al., 2023)
Démarche et outils diagnostiques
Confirmer le diagnostic d’une personne atteinte de la maladie de Parkinson est complexe et peut prendre un certain temps, car elle ne peut être dépistée à l’aide de tests en laboratoires ou de radiographies, et peut être confondue avec d’autres atteintes (AANS, n.d.; Frank et al., 2023a; NIA, 2022; Parkinson Canada, n.d.; Société Alzheimer du Canada, 2021; Ye et al., 2023)
On soupçonne la maladie de Parkinson chez les personnes qui présentent les symptômes moteurs évoqués dans la section précédente, puis l’évaluation clinique de la personne permet d’établir le diagnostic (AANS, n.d.; Gonzalez-Usigli, 2022; Postuma et al., cités dans Shrimanker et al., 2022; Shrimanker et al., 2022; Ye et al., 2023). Le professionnel peut notamment examiner la coordination doigt-nez, les réflexes et la capacité à effectuer des mouvements rapides (Gonzalez-Usigli, 2022). Il peut aussi faire passer un examen neurologique (Gonzalez-Usigli, 2022; NIA, 2022).
Avant de confirmer le diagnostic, en plus de reconnaître les symptômes et de pratiquer un examen clinique, il est essentiel de distinguer la maladie de Parkinson d’autres atteintes à la santé qui peuvent s’en rapprocher. Il faut, par exemple, éliminer les hypothèses suivantes, qui peuvent causer des symptômes similaires : atrophie multisystématisée, paralysie supranucléaire progressive, lésions des tractus corticospinaux, dépression sévère, hyperthyroïdisme et usage d’antipsychotiques ou d’antiémétiques (AANS, n.d.; Frank et al., 2023a; Gonzalez-Usigli, 2022; Postuma et al., cités dans Frank et al., 2023a).
Il est aussi possible de tester la sensibilité de la personne à la lévodopa, principal médicament utilisé dans le traitement de la maladie de Parkinson. Une réponse positive à l’administration de ce médicament souligne généralement l’adéquation du diagnostic de maladie de Parkinson, alors qu’une réponse plus modeste ou l’absence de réponse orientera le diagnostic vers d’autres formes de parkinsonisme ou d’autres atteintes possibles (AANS, n.d.; Gonzalez-Usigli, 2022; Grimes et al., National Institute for Health and Care Excellence, NHS Quality Improvement Scotland, cités dans Frank et al., 2023a; Ye et al., 2023).
Pour confirmer le diagnostic, les avancées technologiques permettent maintenant de détecter les changements métaboliques, tels que les déséquilibres en dopamine, grâce à la tomographie par émission de positrons (AANS, n.d.; Shrimanker et al., 2022; Ye et al., 2023). L’imagerie par résonance magnétique (IRM), en revanche, est déconseillée pour valider un diagnostic de Parkinson selon les lignes directrices, bien qu’elle puisse être utilisée pour écarter les autres hypothèses (Grimes et al., NHS Quality Improvement Scotland, Postuma et al., Quinn, cités dans Frank et al., 2023; Shrimanker et al., 2022; Ye et al., 2023).
Conditions associées
La personne qui souffre d’une maladie de Parkinson peut à l’occasion vivre d’autres atteintes qui semblent plus fréquentes chez ces personnes que dans la population globale, comme :
- La démence à corps de Lewy
- L’atrophie multisystématisée
- Le dysfonctionnement du système nerveux autonome
- La bipolarité
- Les maladies inflammatoires chroniques de l’intestin (p. ex. maladie de Crohn et colite ulcéreuse)
- Les troubles de la thyroïde
- Le syndrome de Sjögren
- La pemphigoïde bulleuse
- Le diabète de type 2
(Al-Hakeem et al., 2024; Bacciardi et al., 2022; Chen et al., Ren et al., cités dans Huttelmaier et al., 2023; Cho et al., 2022; Choi et al., Li et al., Rugbjerg et al., cités dans Cho et al., 2022; Gonzalez-Latapi et Marras, 2022; Kridin et al., 2021; Li, 2023; Li et al., 2023; Mohammadi et al., 2021; NIA, 2022; Schrag et al., 2023; Wu et al., cités dans Gonzalez-Latapi et Marras, 2022)
Intervention pharmacologiques

La première intervention qui sera mise en place est de nature pharmacologique. Son objectif sera de restaurer les fonctions dopaminergiques du cerveau pour estomper les symptômes de la maladie. Il s’agit principalement de la lévodopa (L-Dopa), qui se transforme idéalement en dopamine lorsqu’elle atteint les noyaux gris centraux du cerveau, réduisant ainsi les symptômes moteurs (bradykinésie, rigidité, tremblements) (AANS, n.d.; Gonzalez-Usigli, 2022). Pour éviter qu’elle ne se transforme en dopamine avant d’atteindre le cerveau, ce qui peut causer des effets nocifs et réduire l’efficacité du traitement, on peut l’administrer conjointement avec de la carbidopa (AANS, n.d.; Chopade et al., 2023; Gonzalez-Usigli, 2022; Lieberman et al., cités dans Chopade et al., 2023; NIA, 2022).

Ses effets secondaires sont cependant notables, soit les nausées, les vomissements, les étourdissements et la somnolence quand le traitement débute (AANS, n.d.; Frank et al., 2023b; Gonzalez-Usigli, 2022; NIA, 2022; Shrimanker et al., 2022). À plus long terme, une bouche sèche, des anormalités psychiatriques (p. ex. psychose, confusion, hallucinations) et des troubles moteurs (p. ex. dyskinésies, fluctuations de la fonction motrice) peuvent survenir (AANS, n.d.; Frank et al., 2023b; Gonzalez-Usigli, 2022).
Pour limiter ces effets secondaires et obtenir des effets thérapeutiques optimaux, la dose de L-Dopa sera initialement graduellement augmentée tous les quatre à sept jours, jusqu’à l’atteinte de la dose optimale (Frank et al., 2023b; Gonzalez-Usigli, 2022). Le plus souvent, les effets de la L-Dopa auront tendance à se dissiper au fur et à mesure que progresse la maladie, donnant lieu à des dyskinésies (Gonzalez-Usigli, 2022). Pour pallier cette diminution de l’effet thérapeutique souhaité, d’autres agents pharmacologiques peuvent être administrés en combinaison avec une dose réduite de L-Dopa :
- Amantadine : permet de réduire les dyskinésies apparaissant après l’administration de L-Dopa et de soulager les tremblements.
- Inhibiteurs sélectifs de la monoamine oxydase de type B (IMAO-B) : prolongent l’action de chaque dose de L-Dopa en empêchant sa dégradation.
- Anticholinergiques (inhibiteurs de l’acétylcholine) : efficaces pour réduire les tremblements, surtout dans les cas précoces de la maladie.
- Antagonistes de la dopamine : activent les récepteurs dopaminergiques des noyaux gris centraux.
- Inhibiteurs de la catéchol O-méthyltransférase (COMT) : inhibent la dégradation de la L-Dopa et de la dopamine.
(AANS, n.d.; Brooks, Fernandez et Chen, Müller, cités dans Chopade et al., 2023; Chopade et al., 2023; Fox et al., cités dans Frank et al., 2023b; Gonzalez-Usigli, 2022; NIA, 2022; Shrimanker et al., 2022)
Si le patient souffre également de psychose, la quétiapine et la clozapine peuvent être prescrites pour soulager les symptômes (Grimes et al., cités dans Frank et al., 2023b; Gonzalez-Usigli, 2022).
Intervention médico-chirurgicales
Il est possible d’offrir trois types d’interventions chirurgicales pour traiter les symptômes de la maladie de Parkinson : la thalamotomie, la pallidectomie et la stimulation cérébrale profonde.
- Thalamotomie : Cette intervention consiste en la destruction d’une partie du thalamus par radiochirurgie grâce à des électrodes ou à un scalpel gamma (AANS, n.d.). La thalamotomie peut aider à réduire les tremblements associés à la maladie de Parkinson (AANS, n.d.). Les effets de cette amélioration peuvent être visibles jusqu’à dix ans après l’opération.
- Pallidectomie : La pallidectomie consiste en la destruction d’une partie du paléostriatum (globus pallidus) par radiochirurgie grâce à des électrodes ou à un scalpel gamma. Cette intervention peut aider à réduire certains symptômes de la maladie de Parkinson, tels que les tremblements, la démarche festinante, l’absence de réaction affective, la raideur et la bradykinésie (AANS, n.d.). Les effets peuvent durer jusqu’à cinq ans après l’opération.
- timulation cérébrale profonde stéréotaxique : Cette procédure consiste en l’implantation d’un stimulateur dans le cerveau. Cet appareil, dont la batterie doit être remplacée tous les trois à cinq ans (Valencia, 2020), produit des décharges électriques dans le noyau sous-thalamique, à l’intérieur du paléostriatum (globus pallidus) ou dans le thalamus en vue de minimiser les tremblements (AANS, n.d.; NIA, 2022). La stimulation cérébrale profonde stéréotaxique sera de mise si la personne est réfractaire ou a des effets secondaires intolérables lors du traitement pharmacologique (Gonzalez-Usigli, 2022).
Plusieurs recherches sont en cours, avec pour objectif la découverte d’un traitement qui aurait un impact direct et thérapeutique sur la source même de la maladie, soit la production de dopamine : thérapie génique, facteurs de croissance et transplantation de cellules souches.
Réadaptation

Les personnes atteintes de la maladie de Parkinson doivent maintenir leurs activités quotidiennes afin de rester actives physiquement et d’optimiser l’activité motrice (Gonzalez-Usigli, 2022). La maladie de Parkinson affectant de nombreux systèmes chez les personnes atteintes (physique, moteur, cognitif, affectif, etc.), une équipe interprofessionnelle est le plus souvent mise en place, avec des professionnels de la réadaptation (ergothérapeute, physiothérapeute et orthophoniste), mais aussi un psychologue, un travailleur social, un médecin, une infirmière et parfois un nutritionniste (NIA, 2022; OOPQ, n.d.; Parkinson Canada, n.d.; Shrimanker et al., 2022).
Les interventions en ergothérapie et en physiothérapie peuvent souvent aider la personne à se fixer des objectifs réalistes quant à l’activité physique (p. ex. un programme d’exercices) et à la réalisation des activités de soins personnels, de travail et de loisir (Frank et al., 2023b; Gonzalez-Usigli, 2022; Grimes et al., cités dans Frank et al., 2023b; OPPQ, n.d.). L’aménagement de l’environnement physique de la personne pour l’adapter à ses besoins et aux restrictions physiques que lui cause la maladie permettra de faciliter et de favoriser la mobilité (Gonzalez-Usigli, 2022).
L’intervention en orthophonie pourra permettre de compenser et de contrôler les problématiques de langage et de déglutition (Frank et al., 2023b; Société Alzheimer du Canada, 2021).
Le nutritionniste, quant à lui, peut être consulté pour les problèmes gastro-intestinaux. Par exemple, pour soigner la constipation (induite par les médicaments antiparkinsoniens, l’inactivité ou la maladie elle-même), il pourrait recommander aux personnes de suivre une diète riche en fibres et de consommer une quantité suffisante de liquides (Frank et al., 2023b; Gonzalez-Usigli, 2022).
L’équipe interprofessionnelle pourrait également suggérer de consulter la Société Parkinson Canada, ses divisions régionales et ses groupes de soutien, qui offrent diverses ressources aux personnes atteintes de la maladie et à leurs proches, comme des ateliers, conférences, documents et services de soutien.
Pronostic et séquelles fonctionnelles
Malgré les traitements pharmacologiques disponibles pour augmenter les niveaux de dopamine dans le cerveau et pour soulager les symptômes de la maladie de Parkinson, elle demeure une atteinte progressive et incurable (OMS, 2023; Parkinson Canada, n.d.; Société Alzheimer du Canada, 2021). Chaque personne aura une expression unique de la maladie et de la réponse aux traitements, autant pour la progression, le déclin et les symptômes les plus importants. Toutefois, la maladie progressera inexorablement pour la grande majorité des personnes atteintes, les conduisant éventuellement à l’alitement et aux problématiques qui s’ensuivent, comme le déconditionnement et les infections, qui pourront précipiter le décès.
Références
Agence de la santé publique du Canada (ASPC). (2019). Le parkinsonisme au Canada, y compris la maladie de Parkinson. Gouvernement du Canada. https://www.canada.ca/fr/sante-publique/services/publications/maladies-et-affections/parkinsonisme.html
Al-Hakeem, H., Zhang, Z., DeMarco, E. C., Bitter, C. et Hinyard, L. (2024). Emergency department visits in Parkinson's disease: The impact of comorbid conditions. The American Journal of Emergency Medicine, 75, 7-13. https://doi.org/10.1016/j.ajem.2023.10.017
American Association of Neurological Surgeons (AANS). (n.d.). Parkinson’s Disease. https://www.aans.org/en/Patients/Neurosurgical-Conditions-and-Treatments/Parkinsons-Disease
Bacciardi, S., Elefante, C., Brancati, G. E., Mazzucchi, S. Del Prete, E., Frosini, D., Maremmani, I., Lattanzi, L., Ceravolo, R., Bonuccelli, U. et Perugi, G. (2022). Bipolar Spectrum disorders in Parkinson’s disease: a systematic evaluation. CNS Spectrums, 27(3), 355-361. https://doi.org/10.1017/S1092852920002126
Cho, Y. Y., Kim, B., Shin, D. W., Youn, J., Mok, J. O., Kim, C. -H., Kim, S. W., Chung, J. H., Han, K. et Kim, T. H. (2022). Graves’ disease and the risk of Parkinson’s disease: a Korean population-based study. Brain Communications, 4(1), fcac014. https://doi.org/10.1093/braincomms/fcac014
Chopade, P., Chopade, N., Zhao, Z., Mitragotri, S., Liao, R. et Suja, V. C. (2023). Alzheimer’s and Parkinson’s disease therapies in the clinic. Bioengineering & Translational Medicine, 8(1), e10367. https://doi.org/10.1002/btm2.10367
Frank, C., Chiu, R. et Lee, J. (2023a). Abécédaire de la maladie de Parkinson, partie 1 : le diagnostic. Le Médecin de famille canadien, 69(1), e8-e13. https://doi.org/10.46747/cfp.6901e8
Frank, C., Chiu, R. et Lee, J. (2023b). Abécédaire de la maladie de Parkinson, partie 2 : prise en charge des symptômes moteurs et non moteurs. Le Médecin de famille canadien, 69(2), e26-e32. https://doi.org/10.46747/cfp.6902e26
Goldin, C., Sillau, S., Worledge, E., Bremmer, J., Cummins, R., Tremolet de Villiers, K. et Fullard, M. E. (2023). Reducing the receipt of contraindicated medications in patients with Parkinson disease. Frontiers in Aging Neuroscience, 15, 1 271 072. https://doi.org/10.3389/fnagi.2023.1271072
Gonzalez-Latapi, P. et Marras, C. (2022). Epidemiological Evidence for an Immune Component of Parkinson’s Disease. Journal of Parkinson’s Disease, 12(S1), S29-S43. https://doi.org/10.3233/jpd-223180
Gonzalez-Usigli, H. A. (2022). Maladie de Parkinson. Le manuel MERCK, version pour les professionnels de la santé. https://www.merckmanuals.com/fr-ca/professional/troubles-neurologiques/troubles-du-mouvement-et-troubles-cérébelleux/maladie-de-parkinson
Heitz, C. (2023). Étude des liens entre les troubles du langage et les troubles cognitifs dans la maladie de Parkinson – Partie 2 : Compréhension et production du langage élaboré [mémoire de maîtrise, Université de Liège]. MatheO. https://matheo.uliege.be/bitstream/2268.2/19250/4/S183222%20Heitz%202023.pdf
Huttelmaier, J., Benoit, S. et Goebeler, M. (2023). Comorbidity in bullous pemphigoid: up-date and clinical implications. Frontiers in Immunology, 14, 1 196 999. https://doi.org/10.3389/fimmu.2023.1196999
Kridin, K., Hübner, F., Recke, A., Linder, R. et Schmidt, E. (2021). The burden of neurological comorbidities in six autoimmune bullous diseases: a population-based study. Journal of the European Academy of Dermatology and Venereology, 35(10), 2074-2078. https://doi.org/10.1111/jdv.17465
Li, S. (2023). Progression and Comorbidity of Parkinson’s Disease and Cost-Effectiveness of Regulating Pesticide in Central California [thèse, University of California Los Angeles]. eScolarship. https://escholarship.org/uc/item/42h6z148
Li, M., Wan, J., Xu, Z. et Tang, B. (2023). The association between Parkinson’s disease and autoimmune diseases: A systematic review and meta-analysis. Frontiers in Immunology, 14, 1 103 053. https://doi.org/10.3389/fimmu.2023.1103053
Mohammadi, S., Dolatshahi, M. et Rahmani, F. (2021). Shedding light on thyroid hormone disorders and Parkinson disease pathology: mechanisms and risk factors. Journal of Endocrinological Investigation, 44(1), 1-13. https://doi.org/10.1007/s40618-020-01314-5
National Institute on Aging (NIA). (2022). Parkinson’s Disease: Causes, Symptoms, and Treatments. National Institutes of Health. https://www.nia.nih.gov/health/parkinsons-disease/parkinsons-disease-causes-symptoms-and-treatments
Olsson, E., Byberg, L., Höijer, J., Kilander, L. et Larsson, S. C. (2020). Milk and Fermented Milk Intake and Parkinson’s Disease: Cohort Study. Nutrients, 12(9), 2763. https://doi.org/10.3390/nu12092763
Ordre professionnel de la physiothérapie du Québec (OPPQ). (n.d.). La maladie de Parkinson et la physiothérapie. https://oppq.qc.ca/blogue/maladie-de-parkinson-physiotherapie/
Organisation mondiale de la santé (OMS). (2023). Maladie de Parkinson. https://www.who.int/fr/news-room/fact-sheets/detail/parkinson-disease
Parkinson Canada. (2023). The five stages of Parkinson’s. https://www.parkinson.ca/fr/the-five-stages-of-parkinsons/
Parkinson Canada. (n.d.). Comprendre la maladie de Parkinson. https://www.parkinson.ca/fr/la-maladie/fr-understanding-parkinsons/
Parkinson Montréal-Laval. (n.d.). Comprendre et agir. https://parkinsonmontreallaval.ca/la-maladie/
Poitras, E. (2023). Concevoir des messages personnalisés et offrir des ressources pour les personnes vivant avec la maladie de Parkinson : la perspective de professionnels de la santé [thèse de maîtrise, Université d’Ottawa]. Recherche uO. http://dx.doi.org/10.20381/ruor-29773
Reichmann, H., Csoti, I., Koschel, J., Lorenzl, S., Schrader, C., Winkler, J. et Wüllner, U. (2022). Life style and Parkinson’s disease. Journal of Neural Transmission, 129(9), 1235-1245. https://doi.org/10.1007/s00702-022-02509-1
Roy, A., Choudhury, S., Banerjee, R., Basu, P., Mondal, B., Sarkar, S., Anand, S. S., Dey, S. et Kumar, H. (2023). Dietary and Environmental Risk Factors in Parkinson’s and Alzheimer’s Disease: A Semi‑Quantitative Pilot Study. Annals of Indian Academy of Neurology, 26(2), 174-181. https://doi.org/10.4103/aian.aian_823_22
Schrag, A., Bohlken, J., Dammertz, L., Teipel, S., Hermann, W., Akmatov, M. K., Bätzing, J. et Holstiege, J. (2023). Widening the Spectrum of Risk Factors, Comorbidities, and Prodromal Features of Parkinson Disease. JAMA Neurology, 80(2), 161-171. https://doi.org/10.1001/jamaneurol.2022.3902
Shrimanker, I., Tadi, P. et Sánchez-Manso, J. C. (2022). Parkinsonism. National Library of Medicine. https://www.ncbi.nlm.nih.gov/books/NBK542224/
Simon, D. K., Tanner, C. M. et Brundin, P. (2020). Parkinson Disease Epidemiology, Pathology, Genetics and Pathophysiology. Clinics in Geriatric Medicine, 36(1), 1-12. https://doi.org/10.1016/j.cger.2019.08.002
Société Alzheimer du Canada. (2021). La maladie de Parkinson. https://alzheimer.ca/fr/au-sujet-des-troubles-neurocognitifs/autres-formes-de-troubles-neurocognitifs/troubles-6
Valencia, A. (2020). Deep Brain Stimulation to Treat Parkinson’s Disease. University Health Network. https://www.uhn.ca/PatientsFamilies/Health_Information/Health_Topics/Documents/Deep_Brain_Stimulation_to_Treat_Parkinson.pdf
Verhoeff, M. C., Koutris, M., de Vries, R., Berendse, H. W., van Dijk, K. D. et Lobbezoo, F. (2023). Salivation in Parkinson's disease: A scoping review. Gerodontology, 40(1), 26-38. https://doi.org/10.1111/ger.12628
Ye, H., Robak, L. A., Yu, M., Cykowski, M. et Shulman, J. M. (2023). Genetics and Pathogenesis of Parkinson’s Syndrome. Annual Review of Pathology: Mechanisms of Disease, 18, 95-121. https://doi.org/10.1146/annurev-pathmechdis-031521-034145
Yousif, N. R., Balaha, H. M., Haikal, A. Y. et El-Gendy, E. M. (2023). A generic optimization and learning framework for Parkinson disease via speech and handwritten records. Journal of Ambient Intelligence and Humanized Computing, 14, 10673-10693. https://doi.org/10.1007/s12652-022-04342-6
Zhang, X., Molsberry, S. A., Pavlova, M., Schwarzschild, M. A., Ascherio, A. et Gao, X. (2021). Association of Sleepwalking and REM Sleep Behavior Disorder With Parkinson Disease in Men. JAMA Network Open, 4(4), e215713. https://doi.org/10.1001/jamanetworkopen.2021.5713
Page mise à jour en avril 2024.
